قارچ انسفاليتوزون کونیکولی یک ارگانیسم میکرواسپوریال است که قبلاً به عنوان دلیل بیماری در افراد HIV مثبت، معروف بود، اما در حال حاضر به عنوان یک عفونت فرصت طلب در کسانی که دچار سیستم ایمنی ضعیف هستند، کاملاً شناخته شده است. این ارگانیسم یکی از علل مهم بیماریهای عصبی در خرگوش ها می باشد. در ادامه این مطلب بیماری های قارچی بین انسان و حیوان شامل گونه های قارچ انسفاليتوزون کونیکولی را بررسی میکنیم.
انسفاليتوزون کونیکولی
سبب شناسی
قارچ انسفاليتوزون کونیکولی یک ارگانیسم میکرواسپوردار است که در خرگوش های سرتاسر جهان و همچنین در گستره وسیعی از گونه های پستاندار یافت می شود. این میکرواسپورها، تک یاخته هستند. اینها یوکاریوتهای داخل یاختهای اجباری بوده که به عنوان بیماری زاهای فرصت طلب مهم در افراد دچار سیستم ایمنی ضعیف، به ویژه مبتلایان به HIV/AIDS نمایان می شوند. سه گونه مختلف از انسفاليتوزون کونیکولی شناخته شده است: ۱، ۲ و ۳ که با عناوین “خرگوش”، “موش” و “سگ” نیز شناسایی شده اند.
چرخه یا دورة زندگی
قارچ انسفاليتوزون کونیکولی دارای مرحله کلونیزاسیون مروژنیک هستند که یک مرحلة اسپوروژنیک را در پی دارد. مرحلة اسپوروژنیک با هاگهای عفونی زای کوچک شناخته می شوند که به شدت در مقابل اثرات زیست محیطی و مواد گندزدا مقاوم هستند. هاگها دارای دستگاهِ منحصر به فردی به نام لولة قطبی هستند که از هاگ بیرون زده و به یاخته میزبان جدید نفوذ می کند و اسپوروپلاسم و هسته را به درون آن انتقال میدهد. هم چنین می تواند از این سازوکار برای آلودگی یاخته میزبان با هاگهای بلعیده شده و قرار گرفته شده درون فاگوزومها استفاده نماید. مروژنی، مرحله کلونیزاسیون پس از رشد اسپوروپلاسم درون مرونتها است. اینها به شکل های پلاسمودیال چند هسته ای تکثیر می شوند. در طول مدتی که غشای یاخته های مرونت برای تشکیل اسپرونتها ضخیم می شوند، اسپروژنی موجب رشد اسپروبلاستها و سپس هاگهای بالغ می شود. سپس یاخته باز شده و هاگ ها آزاد می شوند.
توزیع جغرافیایی /همه گیر شناسی
قارچ انسفاليتوزون کونیکولی را میتوان در کل دنیا پیدا کرد. عفونتهای گزارش شده به سال 1959 باز می گردند، هرچند استناد به تشخیصهای ریخت شناسی به این معناست که نمی توان به طور قطعی اعلام نمود که انسفاليتوزون کونیکولی در گزارش های قدیمی علت اصلی بوده و یا می توان گفت که میکرواسپورهای دیگری بوده اند. از لحاظ تاریخی، با وجود شیوع زیاد، این بیماری بیشتر در افراد دچار سیستم ایمنی ضعیف ناشی از HIV/AIDS، پیوند اعضاء یا نقص ایدیوپاتیک در لنفوسیت CD4+T ، وجود دارد. در سال های اخیر و در کشورهای توسعه یافته، شیوع عفونت میکرواسپورها در بیماران مبتلا به HIV/AIDSبه دلیل دسترسی به درمان های ضد رتروویروسی بسیار توانا (HAART)، کاهش پیدا کرده است. عفونت می تواند در افراد دچار سیستم ایمنی ضعیف نیز اتفاق بیفتد، اما نادر است.
قارچ انسفاليتوزون کونیکولی برای اولین مرتبه در خرگوشها شناسایی گردید و سپس در بیش از ۲۰ گونه از پستانداران از جمله انسانها دیده شده است. ظهور و شیوع سرمی در برخی گونه ها به ویژه خرگوش ها زیاد است، که ۲۳ تا ۷۵٪ شیوع سرمی، در آنها گزارش شده است. در پژوهش های مربوط به خرگوش ها، شیوع انسفاليتوزون کونیکولی به دلیل تلاش هایی در خصوص ایجاد جمعیت های بدون بیماری به همراه استانداردهای بهداشتی بالا، نسبتاً کم است اما عفونت در خرگوش های خانگی بومی باقی مانده است. شیوع سرمی در جمعیت های وحشی خرگوش ها شاید به دلیل کاهش تراکم و احتمال مشاهده آنها، پائین تر است. صفر تا سی و هشت درصد شیوع سرمی، در سگهای سالم گزارش شده است. این در حالی است که در اکثر پژوهش ها (حتی در میان پژوهشهایی با جمعیت بالا)، شیوع صفر درصدی سرمی را گزارش نموده اند. در خصوص گربه ها اطلاعات کمی در دست است و در یک مطالعه تنها ۲۴٪ شیوع سرمی گزارش گردیده است. عفونت آزمایشگاهی با گونه های خرگوشی انسفاليتوزون کونیکولی در بچه گربه های تازه متولد شده و تازه از شیر گرفته شده ای که با ویروس پن لکوپنی گربه ها آلوده شده بودند، به همراه گسترش انسفاليتوزون کونیکولی دهانی و ضایعات مغزی به دست آمد. با این حال، مقایسه ی نتایج آزمایشگاهی با مشاهدات واقعی، امری دشوار می باشد. در حالی که ممکن است برخی گربه ها به انسفاليتوزون کونیکولی حساس باشند. نبود گزارشات در مورد بیماری بالینی نشان دهنده ی مقاوم گربه ها نسبت به این ارگانیسم است.
DNA انسفاليتوزون کوتیکولی در مدفوع ۱۳% پرندگان خانگی سالم يافت شده اما رابطه ی پرندگان با انسانها و یا با پرندگان ناشناخته است. در حالی که انسفاليتوزون کونیکولی به شکل آشکار جوندگان را آلوده می سازد. اطلاعات همه گیر شناسی در مورد جوندگان خانگی کم است و در خصوص شیوع سرمی، گسترش یا توانایی انتقال بیماری مشترک از این جانوران، اطلاعات اندک میباشد.
به طور کلی، عفونت با قارچ انسفاليتوزون کونیکولی منجر به بیماری بالینی نمی شود، چرا که به شکل غیرقابل تشخیص و نهفته در خرگوش ها وجود دارد. با این وجود، عفونت های بالینی میتواند در جانوران اهلی به ویژه خرگوش ها، سگها و جوندگان خانگی ایجاد شود. روند عفونت معمولاً کند و آهسته است. به طور معمول برای توسعه ی هاگ ها در بدن خرگوشها، هفته ها و ماهها زمان نیاز است، حتی در سطوح زیاد هاگ، ممکن است بیماری بالینی مشخص نشود. به نظر می رسد عفونت ابتدا در کلیه ها و سپس گسترش به مغز ایجاد میشود. سرم های پادتن معمولاً سه هفته از شروع عفونت قابل ردیابی هستند. این روش نسبت به واکاوی ارگانیسم های داخل یاخته ای یا دفع آنها در ادرار، ارجحیت دارد. ضایعات مغزی معمولاً تنها در هفته هشتم یا بیشتر و پس از شیوع سرمی، قابل واکاوی می باشند.
هاگ ها می توانند از راه مایعات مختلف بدن به خصوص مدفوع، ادرار و ترشحات تنفسی انتقال یابد و شاید ادرار اصلی ترین راه گسترش باشد. هاگ ها را می توان ۳۸ تا ۶۳ روز بعد از عفونت آزمایشگاهی به همراه انتشار متناوب و کم، شناسایی نمود. بلع تخم های قارچ، علت اصلی عفونت است. عفونت همچنین می تواند از راه تنفس هاگ ایجاد شود. عفونت از راه جفت و یا خارج رحمی نیز ممکن است در برخی گونه ها مانند خرگوش ها، اتفاق بیفتد.
عفونت های انسانی به طور معمول نادر هستند، گرچه ممکن است عفونت های خفیف رایج تر بوده اما نادیده گرفته می شوند. درصد کمی از جمعیت سالم انسانی دارای پادتن ضد انسفاليتوزون کونیكولی هستند که قرار گرفتن در معرض بیماری را نشان میدهد. داده های مربوط به شیوع سرمی گوناگون است و گستره ای از 9/3% تا 42% را دارد که با میزان بالاتر، در افراد دچار سیستم ایمنی ضعیف، کسانی که سابقه بیماری های گرمسیری را دارند و یا بازدیدکنندگان کشورهای گرمسیری مشاهده میشود. سرم مثبت در افراد جوانتر ( ۱۹ سال) کاهش یافته در طول زمان، رایج تر می باشد. در خصوص عفونت انسانی، گروه ۱ (گروه خرگوشها) و ۲ (گروه سگها)، به علت هم نشینی با جانوران از نگرانی بیشتری برخوردار هستند.
با توجه به داده های مربوط به شیوع قارچ انسفاليتوزون کونیکولی در انسان ها نسبت به جانوران و همچنین دادههای همه گیر شناسی مولکولی، بیماری زایی این ارگانیسم در انسان ها به شکل طبیعی کم میباشد. در حالی که انتقال مستقیم حیوان به انسان هنوز تأیید نشده است، عفونت های قارچ انسفاليتوزون کونیکولی انسانی، به عنوان یک بیماری مشترک در نظر گرفته میشوند. اطلاعات گسترده ای در خصوص انتقال بیماری مشترک به شکل تصادفی و با توجه به موقعیت موجود می باشد. بیمارانی که توسط گونه های سگها و خرگوش ها آلوده شدهاند، تماس با سگها و خرگوش ها را گزارش نموده اند. گزارشی در خصوص تائید ارگانیسم های غیر قابل تشخیص انسانی و پیوند آنها با تماس های حیوانی نشده است. در گزارشی سگها به عنوان منبع عفونتِ یک آرایشگر مبتلا به HIV معرفي شده اند، فرضیه ای که ضعیف است. در گزارش های دیگری، این مسئله مورد توجه قرار گرفته است که افراد آلوده شده، قبلاً با خرگوش ها و سگها تماس داشته اند. این نکته به روشنی قادر به ارائه ی شواهد نمی باشد. شناساییِ شیوع سرمی در کودکی که در معرض یک توله سگ آلوده قرار گرفته است، توانایی انتقال را بیشتر می کند.
قارچ انسفاليتوزون کونیکولی
جانوران
نشانه های بالینی
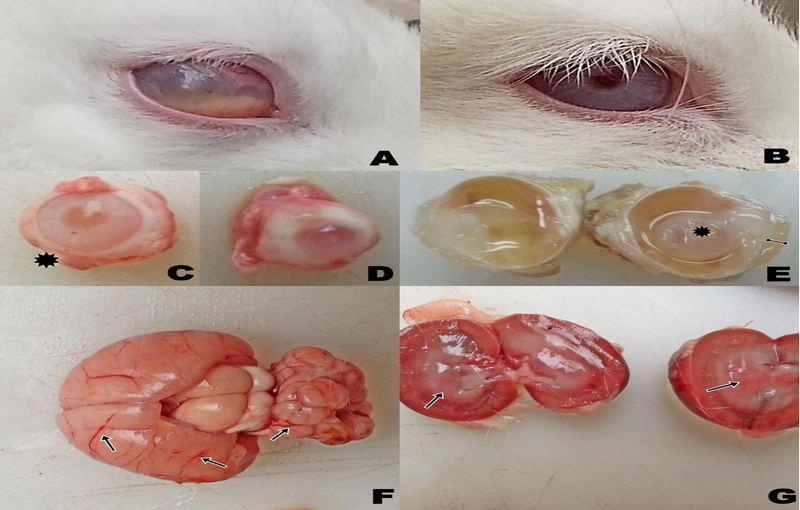
قارچ انسفاليتوزون کونیکولی در خرگوش ها باعث عفونت های مختلفی از بیماری عصبی پنهان تا شدید می گردد. شروع بیماری ممکن است در پی یک اتفاق استرس زا باشد. شایع ترین نشانه ها و نشانه های بالینی بیماری عصبی، نشانه های دهلیزی می باشد. شروع بیماری معمولاً به طور ناگهانی است. کج شدن سر، ناهماهنگی حرکتی، فلج ناقص یا از کار افتادگی و سرطانهای سر رایج هستند. تغییرات رفتاری، پرخاشگری، نقص اعصاب جمجمهای معمولاً کمتر مشاهده شده اند. بیماری های چشمی و کلیوی نیز ممکن است به همراه یا مستقل از بیماریهای عصبی توسعه یابد. نشانه های بینایی معمولاً یک طرفه بوده و شامل یووئیت و آب مروارید است. در معاینات بیشتر عفونت های کلیوی خفیف و غیر قابل تشخیص هستند، اما نارسایی کلیه نیز ممکن است مشاهده شود.
سندرم التهاب مغز-کلیه در سگها رایج تر است و با کوری، توقف رشد و التهاب کلیه شناخته می شود. ممکن است افسردگی، بی علاقگی و کاهش وزن مشاهده شود که بیماری عصبی، ناهماهنگی حرکتی، هایپرمتریا، کوری مرکزی و حرکت دایره ای را به دنبال دارد.
بیشتر جانوران مبتلا کمتر از یک سال دارند. در گزارشی 19/17 درصد از سگ ها، 4 تا ۱۰ هفته داشته اند.
تشخیص
تشخیص قطعی قارچ انسفاليتوزون کونیکولی قبل از مرگ دشوار است، چرا که نشانه های بالینی کمک زیادی به تشخیص بیماری نمیکنند و محدودیت هایی در آزمایش های تشخیصی وجود دارند. تشخیص احتمالی (به ویژه در خرگوشها) معمولاً بر اساس نشانه های بالینی و آزمایش سرم شناسی انجام می شود. میزان بالای شیوع سرمی در خرگوش های سالم، ارزیابی آزمایش سرم شناسی را پیچیده می سازد، در نتیجه مانع تشخیص قطعی می شود. نتایج سرمشناسی منفی به دلیل کمی عفونت بالینی و قابل تشخیص توسط پادتن ها، دارای پیش بینی نبود بیماری هستند. آزمایش سرم شناسی ممکن است در سگها بیشتر از خرگوشها ارزشمند باشد، چرا که شیوع بیماری در سگها در برخی مناطق کمتر است، اما برتری آشکار بیماری در توله سگهای جوان (و نابالغ از لحاظ دستگاه ایمنی) ممکن است اعتبار آن را تحت تأثیر قرار دهد. ارزیابی عیارهای شیوع سرمی در شرایط حاد و نقاهت بیماری، به دلیل شروع تدریجی و دیر بیماری (با توجه به زمان تماس)، کاربردی نیست.
تشخیص هاگ های داخل یاخته ای در ادرار، مدفوع یا بافت مناسب است، اما می تواند مشکل ساز باشد. نتایج آزمون ها روی نمونه های کلیه و مغز بهتر است، اما بدیهی است این موارد به راحتی در جانوران زنده در دسترس نخواهد بود. هاگها گاهی اوقات در مدفوع یا ادرار جانوران آلوده یافت می شوند. رنگ آمیزی تریکروم اصلاح شده یا رنگ آمیزی کیتینِ فلوروفورس می توانند برای تشخیص میکروسکوپیِ هاگها مورد استفاده قرار بگیرند، اگرچه دسترسی به هر کدام از این روشها سخت و تعداد افراد با تجربه در تشخیص میکروسپورها کم می باشند. مشاهده هاگ در ادرار و مدفوع همراه با نشانه بالینی مشخص، ما را در رسیدن به تشخیص نهایی و قطعی کمک می کند، ولی عدم وجود بیماری نمی تواند در تشخیص نهایی کمک کننده باشد؛ زیرا پخش بیماری می تواند توسط برخی از جانوران صورت بگیرد، هرچند ظاهراً بیماری در آنها وجود نداشته باشد.
واکنش زنجیرهای پلیمراز را می توان برای تشخیص هاگ ها در ادرار یا دیگر مایعات بدن انجام داد، گرچه معمولاً در دسترس نمی باشد. حتی زمانی که در دسترس باشد، نظر به این که DNA انسفاليتوزون کونیکولی موجود در مایعات بدن، ارتباط واقعی با بیماری را نشان نمی دهد، سودمندی PCR را نامشخص می کند. علاوه بر این به دلیل انتشار ناهمگون هاگها، نتایج منفی در نمونه های ادراری و عدم مشاهده ی التهاب مغز، این بیماری را نفی نمی کند.
هیستوپاتولوژی ابزار تشخیصی خوبی برای بیوپسی و یا نمونه گیری های بعد از مرگ می باشد. با این وجود، هاگهای انسفاليتوزون کونیکولی به طور معمول با استفاده از رنگ آمیزی هماتوکسیلین و ائوزین، رنگ نمیشوند و می توانند ناپیدا باشند، به ویژه اگر پاتولوژیست از بیماری زایی میکرواسپوری آگاه نباشد و یا تجربه کمی در تشخیص این ارگانیسم ها داشته باشد.
درمان
در خصوص درمان قارچ انسفاليتوزون کونیکولی اطلاعات محدودی وجود دارد. در خرگوشهای مبتلا به بیماری عصبی، سه عامل باید در نظر گرفته شود: حذف ارگانیسم ها، کاهش التهاب و مهار تشنج. پاسخ های گوناگونی در مورد آلبندازول، فنبندازول و کورتیکواسترئیدها به همراه فنبندازول دیده شده و به به عنوان داروی انتخابی در خرگوشها، گزارش گردیده است. مدارک و شواهد تازه نشان می دهند که ملوکسیکام ممکن است بسیار مفید باشد. بهبود بدون درمان، هنوز ثبت نشده است.
در خصوص درمان نارسایی کلیه اطلاعاتی وجود ندارد و مراقبت های حمایتیِ عمومی و استفاده از فنبندازول به احتمال زیاد گزینه های منطقی و خوبی می باشند. درمان سنتی روی يووئيت خوب نیست، چراکه درمان موفقیت آمیز با تجویز سیستمیک و موضعیِ دگزامتازون و اکسی تتراسایکلین گزارش شده است. برداشت سریع عدسیها به همراه درمان دارویی، از تأثیرگذارترین راهکارها خواهد بود. ممکن است در موارد مزمن نیز درآرودن کامل عدسی نیاز باشد.
پیش آگهی بیماری در خرگوشهای مبتلا به شکل عصبی خوب است. در مطالعه ای، %۵۴ خرگوشهای مبتلا به بیماری عصبی پس از چند روز بهبود یافتند. در صورت وجود نارسایی کلیه، پیش آگهی بیماری ضعیف خواهد بود.
هیچ اطلاعات واقعی در مورد درمان سگها وجود ندارد. رویکردی مشابه با آنچه برای خرگوش ها انجام شد، منطقی می باشد، گرچه بیماری در سگهای بیمار توسط انسفاليتوزون کونیکولی، پیشرفته تر است و پیش آگهی بیماری در سگهای مبتلا ضعیف می باشد.
انسانها
نشانه های بالینی
عفونت انسفاليتوزون کونیکولی می تواند منجر به گستره وسیعی از سندرمها شامل پریتونیت، التهاب کبد، التهاب پیشابراه، التهاب پروستات، التهاب کلیه، التهاب سینوسها، التهاب ملتحمه، التهاب مثانه و اسهال گردد. همچنین می تواند با گسترش عفونت در افراد مبتلا به سیستم ایمنی ضعیف همراه باشد؛ اما التهاب مغز گرانولوماتوز بهترین تظاهر آن است. آن را به عنوان التهاب مغز توکسوپلاسمایی تقلیدی توصیف می کنند که یک تشخیص افتراقی مهم در افراد مبتلا به سیستم ایمنی ضعیف است. این نوع عفونت در افراد مبتلا به سیستم ایمنی ضعیف، به شدت نادر است.
تشخیص
تشخیص قطعی قبل از مرگ می تواند دشوار باشد. هاگها را می توان در مایعات مختلف بدن با استفاده از رنگ آمیزی اصلاح شدة تریکروم، رنگ آمیزی نقره ای وارتین- استری یا رنگ آمیزی کیتینِ فلوئوروفرس شناسایی نمود. بسته به محل و موقعیت عفونت، نمونه ادرار یا مایع مغزی نخاعی، مانند نمونه های اپی تلیوم روده ای و صفراوی، اپی تلیوم قرنیه یا ملتحمه، اپی تلیوم لوله کلیوی، اپی تلیوم دستگاه تنفسی فوقانی و تحتانی یا اورواپيتليوم، ممکن است برای انجام آزمایش مناسب باشند. نمونه های بیوپسی یا کالبد شکافی نیز میتواند با استفاده از گونه های مختلف مورد استفاده قرار بگیرد. PCR از قابلیت استفادة بالایی برخوردار است و روشی خاص و حساس می باشد. سرم شناسی به دلیل اختصاصی نبودن، کاربرد کمی دارد؛ اگرچه استفاده از آزمایش های مربوط به شناسایی آنتی ژن لوله های قطبی برای تشخیص بازنگرانة انسفاليتوزون کوتیکولی مفیدتر باشند.
درمان
آلبندازول به عنوان داروی انتخابی است. بهبود عملکرد ایمنی بدن نکته ای حیاتی است اما همیشه امکانپذیر نمی باشد. بایستی عفونت در افراد بدون اختلال سیستم ایمنی (به ویژه از نظر بیماری HIV) مورد بررسی بیشتر قرار گیرد.
پیشگیری
غربالگری منظم خرگوشهای خانگی بسیار توصیه شده است، با این حال توجیه آن دشوار است. زمانی که بروز اندک بیماری در انسان ها، احتمال خطر پائین افراد مبتلا به ضعیف سیستم ایمنی و شیوع بالا در جانوران سالم مورد بررسی قرار گیرد، غربال گری سؤال برانگیز است. علاوه بر این، درمان قطعی در مورد خرگوش های سالمی که انسفاليتوزون کونیکولی را پخش می کنند، وجود ندارد؛ بنابراین پاسخ واقعی نتایج غربالگری نامشخص خواهد بود. حذف جانوران مثبت از خانواده توصيه عاقلانه ای نیست و با توجه به محدودیت آزمایشهای تشخیصی، نمی توان با اطمینان بیان کرد که یک حیوان منفی واقعاً منفی است. بنابراین بهتر است کوششها در جهت اقدامات عملی نظارت بر عفونت در خانواده ها (به منظور کاهش خطر تماس با جانوران پخش کنندة انسفاليتوزون کونیکولی)، انجام گیرد. به طور خاص، افراد مبتلا به سیستم ضعیف ایمنی، باید از تماس با ادرار یا مدفوعِ خرگوش اجتناب کنند، از تمیز کردن قفس خرگوشها بپرهیزند و به بهداشت فردی مناسب، به خصوص بهداشت دست ها، توجه کنند. در صورت تمیز کردن قفس توسط یک فرد پرخطر، باید دستکش استفاده شود. برای دوری از ذرات معلق و آلوده در هوا، قفس باید پس از تمیز کاری ضد عفونی و دستها پس از درآرودن دستکش ها کاملاً شسته شوند. خرگوش هایی که آموزش مربوط به محل دفع مدفوع را ندیده اند، مجاز به پرسه زدنِ آزاد در خانه نیستند.
جانورانی که از نظر بالینی درگیر شده اند، باید به عنوان پخش کنندگان انسفاليتوزون کونیکولی از راه ادرار در نظر گرفته شوند. بنابراین عفونی زا بودن آنها در زمان عفونت بالینی، نامشخص است. خطر انسانهای مبتلا به سیستم ایمنی ضعیف پائین است، اما اقدامات منطقی باید در جهت کاهش خطر تماس انسانها با دیگر جانوران به کار گرفته شود. این مورد در ابتدا شامل؛ اجتناب از تماس با ادرار خرگوشها (با به کارگیری پوشش محافظتی مناسب و بهداشت فردی) می باشد. قفسها و مناطقی که با ادرار آلوده شده اند، باید تمیز و ضدعفونی شوند. برای کاهش انتقال غیر مستقیم از راه کارکنان یا ذرات بی جان، جداسازی جانوران آلوده مهم است، اما به منظور مهار جانوران آلوده در کل خانواده یا منطقه مسکونی، باید احتیاط لازم توسط بیمارستان های دامپزشکی انجام شود.
تعیین نحوه ی سرایت بیماری به دلیل وجود توانایی انتشار متناوب (پس از درمان) و حساسیت نامشخص آزمایش ها، از ارزش کمی برخوردار است.
هاگهای انسفاليتوزون کونیکولی در برابر تنش های زیست محیطی بسیار مقاوم اند و قادر به بقا در محیط زیست برای مدت های طولانی هستند. آنها علاوه بر حساسیت نسبت به بسیاری از مواد ضد عفونی کننده شامل؛ اتانولِ ۷۰٪، پروکسید هیدروژن ۱٪ و هیپوکلرید سدیم 01/0 % (سفید کننده)؛ به گرما (جوشاندن به مدت پنج دقیقه، و اتوکلاو ۸۵ درجه سانتی گراد برای ۲ تا ۶ دقیقه) نیز حساس هستند.
انسفاليتوزون هلم
انسفاليتوزون هلم یک عامل نادر، عفونی زا و میکرواسپوریال در جانوران و انسانها می باشد که تنها گزارش محدودی از عفونت انسانی را داشته که تقریباً همه آنها مبتلا به HIV/AIDS بوده اند. هنوز مشخص نشده است که این گونه انسفاليتوزون رواج کمتری دارد، حدت کمتری دارد یا تشخیص آن مشکل تر است؛ اما شاید یکی از نادرترین عفونتها می باشد. این مورد تنها در شماری از افراد با سیستم ایمنی ضعیف گزارش شده است و در تمامی موارد با عفونت همزمان با بیماری زای دیگری یافت شده، بنابراین نشانه های بالینی آن نامعلوم است.
در بیماران مبتلا به HIV/AIDS عفونت های منتشر و عفونت بینایی شایع تر است، هرچند عفونتهای تنفسی نیز می تواند ایجاد شود. شاید کراتوکانجکتیویت، شایع ترین تظاهر بالینی عفونت باشد. این ارگانیسم را می توان همچنین در تعداد کمی (6/1٪) از افراد مبتلا به سیستم ایمنی ضعیف و بدون علامت، یافت.
همه گیر شناسی انسفاليتوزون هلم به شکل ضعیفی بیان شده است. انسفاليتوزون هلم در گونه های متنوعی از پرندگان، به ویژه طوطی سانان، (سالم و بیمار) یافت شده است. مطالعه ای روی ۲۷۸ پرنده از نوع طوطی سانان، Passeriformeها و Columbiforme موجود در فروشگاه جانوران خانگی، پرورش دهندگان و خانواده هایشان انجام شد که؛ انسفاليتوزون هلم را در 3/8 درصد از آنها شناسایی نمود که شامل گونه های متنوع و متفاوتی بود. ممکن است عفونت همزمان با میکروسپورهای دیگر نیز ایجاد شود.
عفونت مزمن و غیر قابل تشخیص اتفاق می افتد و دفع مدفوع توسط پرندگان (حداقل در مرغ عشقها) ممکن است مسری باشد، بنابراین ممکن است نمونه های انفرادی باعث کاهش ظاهری شیوع شود. شیوع بالینی انسفاليتوزون هلم در پرندگان نامشخص است گرچه در برخی گونه های پرندگان، اسهال و مرگ می تواند ناشی از این بیماری باشد. همچنین انسفاليتوزون هلم در دیگر گونه های حیوانی مانند خفاش های میوة مصری و خرگوش های قهوه ای صحرایی اروپا نیز یافت میشود.
سبک و روش انتقال ناشناخته است اما با توجه به این که ارگانیسم می تواند در مدفوع گسترش یابد، انتقال مدفوعی-دهانی امکان پذیر است. علاوه بر این، گزارش های بیماری تنفسی نشان میدهد که تنفس هاگها، شاید از راه یک ریز قطره مدفوعی و عفونی زا، مسیر جدی دیگری برای انتقال باشد.
در این زمینه، مدارک و شواهد وجود خطر مشترک بین دام و انسان کم است. به طور طبیعی و تجربی، پرندگان آلوده می توانند انسفاليتوزون هلم را از راه مدفوع به افراد دچار سیستم ایمنی ضعیف انتقال دهند؛ اگرچه پیوند بالینی این مسئله نامعلوم است. انتقال بیماری مشترک در برخی موارد توسط فرد آلوده که با پرندگان خانگی در تماس است، اتفاق می افتد، اما در حال حاضر مدارک مشخصی وجود ندارند. برخلاف ظهور کم بیماری و وجود ارتباط ضعیف در مورد ایجاد بیماری مشترک از جانوران اهلی، گسترش مدفوعیِ انسفاليتوزون هلم توسط طوطی سانان و به طور قطع عفونت انسانی امکان پذیر است و یکی از دلایل بیماری در افراد مبتلا به سیستم ایمنی ضعیف، به ویژه آنها که مبتلا به
HIV/AIDS یا نقص عملکردی لنفوسیت T هستند، می باشد که بایستی از تماس با پرندگان خانگی و مدفوع آنها دوری کنند. هیچ مدرکی وجود ندارد که نشان دهد غربال گری پرندگان خانگی (از نظر انسفاليتوزون هلم) مفید یا عملی بوده است. به علت نگرانی در مورد این ارگانیسم، توجه به بهداشت، به ویژه دوری از تماس با مدفوع و محدود نمودن تماس بین افراد مبتلا به سیستم ایمنی ضعیف و پرندگان خانگی، ضروری است.
انسفاليتوزون بینوسی
مقدمه
این ارگانیسم شایع ترین علت عفونت های میکروسپوری در انسان هاست که باعث ایجاد اسهال در افراد با سیستم ایمنی ضعیف (دنبال HIV/AIDS) میشود. همچنین می تواند در گونه های متفاوت حیوانی، مانند گربه ها و سگهای سالم نیز یافت شود. نقش جانوران خانگی در عفونت های انسانی، غیرواضح و شاید اندک است اما قابلیت انتقال بیماری مشترک بین انسان و دام در جانوران خانگی را نمی توان نادیده گرفت.
سبب شناسی
میکرواسپورها به طور باورنکردنی یک گروه بسیار بزرگ و گسترده از یوکاریوتهای داخل یاختهای اجباری و تک یاختهای اند که می توانند گستره وسیعی از پستانداران و حشرات را آلوده کنند و به عنوان بیماری زاهای فرصت طلب مهم، در افراد مبتلا به HIV/AIDSدر نظر گرفته شده اند. در ابتدا میکرواسپورها همراه با ژیاردیا، تریکوموناس و انتامبهآ، در طبقهی آرکیزوآها طبقه بندی شدند. اگرچه شواهد جدید نشان میدهند که آنها قارچ های تخصص یافته تری هستند. چرخه ی زندگی، دقیقاً مشابه آن چیزی است که در بالا برای انسفاليتوزون کوتیکولی شرح داده شد.
پراکندگی جغرافیایی / همه گیر شناسی
انسفاليتوزون بینوسی در تمام جهان وجود دارد. عفونت های درمانگاهی به طور وسیعی محدود به کسانی است که مبتلا به HIV/AIDSبوده و دچار سیستم ایمنی ضعیف اند.
اگرچه مواردی از درگیری به طور اتفاقی در کسانی که به دلایل دیگری دچار تضعیف ایمنی شده اند، به خصوص پیوند عضو، گزارش شده است. همچنین به ندرت عفونت، در افرادی با ایمنی سالم و افراد HIV منفی، تشخیص داده شده و این موارد نشان میدهد که این مساله ممکن است به علت تخمین کم بیماری در این افراد، به دلیل ماهیت خفیف سماری، سختی در تشخیص عفونت و نبود آزمونهای رایج در افراد مبتلا به اسهال، در جامعه باشد. در افرادی با ایمنی سالم اما مسن (به علت کاهش عملکرد ایمنی با افزایش سن)، خطر بالاتری وجود دارد، ولی این موضوع هنوز ثابت نشده است.
همچنین انسفاليتوزون بینوسی می تواند از درصد کمی از افراد بدون اسهال نیز جداسازی شود، همانند؛ مطالعه ای که وجود ارگانیسم را در ۳٪ افراد با HIV/AIDSگزارش کرد.
اگرچه اولین شمار انسفاليتوزون بینوسی در انسان ها گزارش شد ولی در گونه های متفاوتی، به ویژه خوکها نیز ردیابی شده است. نرخ بالایی از افزایش ابتلا در برخی خوک های سالم، به ویژه در خوکهای تازه از شیر گرفته شده، تشخیص داده شد. بنابراین در بقیه گونه ها مثل گوساله ها، یک بزغاله، یک لاما، جوجه تیغی ها، پرندگان و برخی جانوران بدون پشم، اسبها و پريماتها نیز یافت شد.
انسفاليتوزون بینوسی را می توان در مدفوع سگها و گربه های سالم یافت. اطلاعات در مورد شیوع محدود است؛ اما ارگانیسم و یا DNA آن، در ۱۵٪ سگ های ولگرد در کلمبیا، ٪7/1 از سگ های ولگرد و ۵٪ از جانوران خانگی در ژاپن و 3/8 % از سگ های مزرعه در سوییس یافت شده است. به طور مشابه DNA انسفاليتوزون بینوسی در ۱۷٪ گربه های ولگرد در کلمبیا و 3/8 % از گربه ها در سوییس تشخیص داده شد.
پژوهش ها در مورد جانوران نگهداری شده در خانه اندک است. دفع و گسترش عامل در مدفوع، در 5/%12 پرندگان قفسی، بسیاری از طوطی سانان، گنجشک سانان و کبوت سانان گزارش شده است. کلونیزاسیون در ۵% از خوکچه هایی با سویه ی غیرمعمول گزارش شده که شاید از خوکچه های هندی منشأ گرفته اند اما همچنین می تواند انسان ها را عفونی کند.
ژنوتیپ یافت شده در سگها و گربه ها می تواند مشابه آنهایی باشد که در انسان دیده شده، که نگرانی در مورد توانایی انتقال یک بیماری مشترک دام و حیوان را افزایش می دهد. سگها به عنوان منشأ عفونت با انسفاليتوزون بینوسی و انسفاليتوزون کونیکولی در افراد HIV مثبت، است. اگرچه این نکته تنها براساس شغل کسانی که از سگها مراقبت می کرده اند، به دست آمده و اطلاعات کمی برای تأیید این فرضیه وجود دارد. متقاعد کننده ترین شواهد در مورد وجود بیماری مشترک دام و انسان، موردی بود که سویهی مشابه انسفاليتوزون بینوسی را، در یک کودک با ایمنی سالم، همراه با میکروسپوریدوزیس رودهای و همچنین در 7/8 خوکچه های هندی خانگی تشخیص داده بود. نقش جانوران خانگی در عفونت انسانها محدود است، اگرچه اطلاعات مشخصی در مورد همه گیر شناسی این بیماری زا وجود ندارد؛ اما توانایی عفونی زایی این عامل از راه حیوان خانگی مورد تأیید است. فاکتورهای خطر در مورد کلونیزاسیون و عفونی زایی انسفاليتوزون بینوسی به خوبی شناخته نشده، ولی تصور می شود شرایط بهداشتی ضعیف یک عامل خطرساز و مهم است. مسیر دهانی – مدفوعی، دهانی – دهانی، تنفس ذرات عفونی و بلع غذای آلوده، همگی به عنوان منابع ممکن برای انتقال پیشنهاد شده اند. دوره نهفتگی نامعلوم است.
جانوران
اطلاعات کمی در مورد توانایی انسفاليتوزون بینوسی در بیماری جانوران همراه، وجود دارد. تاکنون، اطلاعاتی که تعیین کند آیا این ارگانیسم یک بیماری زا در گونهی جانوران خانگی به حساب می آید یا خیر، وجود ندارد. تشخیص برای انسان ها باید براساس موارد توضیح داده شده در زیر باشد. هیچ اطلاعاتی در مورد درمان وجود ندارد.

انسان ها
تظاهرات بالینی
اسهال شایع ترین مشکل در بیماران مبتلا به HIV/AIDS است که با شیوعی بیش از ٪۵۰ در برخی گروههای بیماران دارای اسهال دیده میشود. اسهال به مقدار زیادی به وضعیت سیستم ایمنی فرد وابسته است.
شاید اسهال مزمن شایع تر باشد و یا به طور شایع تر، قارچ انسفاليتوزون کونیکولی بینوسی یک بیماری مزمن باشد تا نوع حاد. همچنین بدی جذب و کاهش وزن ممکن است جزیی از عفونت درونی انسفالیتوزون بینوسی باشد. بیماری ریوی به ویژه التهاب بینی و مجاری تنفسی هم بیان شده، ولی غیرمعمول اند.
تشخیص
استفاده از روش غربالگری در تشخیص به دلیل اندازه ی کوچک ارگانیسم و دشواری در تشخیص، مشکل است. یک فرد باتجربه به کمک میکروسکوپ (متخصص کار با میکروسکوپ) می تواند هاگهای میکرواسپور را از مدفوع و نمونه دوازده با استفاده از رنگ های کروموتروپ، تشخیص دهد. همچنین هاگها می توانند به روش بافت شناسی در نمونه های بیوپسی درونی، تشخیص داده شوند اما این روش در تشخیص رایج در افراد مبتلا به اسهال قابل پاسخگویی نیست. هاگها می توانند در برش های بافتی با استفاده از رنگهای مختلف از جمله گیمسا، گرم و اسيدفست شناسایی شوند. بررسی دقیقی نیاز است؛ چرا که هاگها به دلیل اندازه بسیار کوچک شان، رنگ پذیری کم و پاسخ التهابی اندک در بافت ها، به آسانی نادیده گرفته می شوند. هیچ کدام از این روش های غربال گری قادر نیستند بین میکروسپوریدی های مختلف، تفاوتی را نشان دهند. PCR حساسیت و اختصاصیت بیشتری دارد و شاید در آینده به طور وسیع تری استفاده شود.
درمان
بهبود عملکرد ایمنی، فاکتوری اساسی است و در برخی بیماران، جنبه ی بسیار مهمی از درمان است. تجویز درمان ضد رتروویروسی (HAART) در بیماران مبتلا HIV/AIDSبا اسهال ناشی از آنسفالیتوزون بینوسی، می تواند منجر به بازگشت و پس رفت بیماری شود. اگر گزارشی از عفونت در فردی با سیستم ایمنی سالم مشاهده گردید، باید برایش آزمون عفونت HIV انجام شود. اطلاعات اندکی در مورد بهترین درمان وجود دارد. به نظر می رسد فوماژیلین داروی انتخابی باشد. آلبندازول درمان اصلی برای عفونت انسفاليتوزون اینتستینالیس است و در برابر انسفاليتوزون بینوسی کارآمد نیست. در افرادی با سیستم ایمنی سالم، بیشتر اوقات عفونت خفیف است.
پیشگیری
توصیه های علمی برای برخورد با کسانی که عفونت قارچ انسفاليتوزون کونیکولی بینوسی اکتسابی دارند، بسیار سخت است. آزمایش جانوران خانگی می تواند انجام شود اما مفید بودنشان ثابت نشده است. تفاوتی در مورد شناسایی ارگانیسم؛ در جانوران خانگی، بین این که جانوران خانگی منبع عفونت اند یا انسان آنها را عفونی کرده و این که یک راه عفونت مشترک وجود دارد یا ارتباطی بینشان نیست، وجود ندارد. تعیین ژنوتیپ ارگانیسم و نشان دادن همان سویه در یک فرد و یک حیوان خانگی، اطلاعت بیشتری را فراهم می کند، ولی هنوز نمی تواند مسیر انتقال را مشخص کند و یا وجود منبع عفونت مشترک را تأیید کند. علاوه بر این تاکنون اطلاعاتی مربوط به درمان جانوران وجود ندارد و درمان ناقلین شاید بدون کاربرد باشد. از آنجایی که آزمایش ها اطلاعات یا نتایج خاصی نمی دهد، بنابراین قضاوت بسیار مشکل است. در بیمارستان های انسانی، جلوگیری از تماس، فقط برای کودکان دارای اسهال مرتبط با انسفاليتوزون بینوسی (که نمی توانند خودبه خودی مهار نمی شود)، توصیه شده است. جداسازی افراد مبتلا در خانواده عاقلانه نیست، اما در مورد رعایت بهداشت عمومی، برای کاهش خطر انتقال انسان به انسان و انسان به حیوان باید تأکید شود. در خانواده ای با افراد پرخطر، غربالگری جانوران خانگی سالم توصیه شده است. روش های غربال گری مناسبی شناخته نشده و اطلاعات کافی در مورد همه گیر شناسی ارگانیسم، برای تفسیر نتایج به دست آمده، فراهم نیست. یک نتیجه منفی تنها یک احساس امنیت دروغین ایجاد می کند؛ به ویژه اگر دفع متناوب عامل، عفونت متوالی و یا کمی حساسیت در آزمایش وجود داشته باشد. دلیلی وجود ندارد که جانوران خانگی مثبت، از خانه دور نگه داشته شوند و یا درمان شوند. علاوه بر این، اقداماتی که برای جابه جایی جانوران خانگی مثبت (مثل اجتناب از تماس با مدفوع و بهداشت دستها) توصیه می شوند، باید بدون در نظر گرفتن شرایط جانوران خانگی مبتلا به قارچ انسفاليتوزون کونیکولی بینوسی، انجام شوند. نقش محیط در انتقال واضح نیست. با توجه به توانایی انتقال دهانی – مدفوعی و مشاهدهی عفونت در شرایط بهداشتی ضعیف، محیط خانواده یا بیمارستان می تواند یک منبع عفونت باشد؛ اما عامل اصلی ناشناخته است. هاگ های میکرواسپور نسبت به اثرات محیطی و ضدعفونی کننده ها بسیار مقاوم اند و می توانند، برای دوره های زمانی طولانی، در محیط زنده بمانند. با چند نوع ضدعفونی کننده از جمله ماده سفیدکننده (به نسبت 1 به ۳۰)، اتانول ۷۰٪، آمونیومهای چهارتایی و پراکسید هیدروژن مهار میشوند.
این تجربه است که کمک می کند در هر تجارتی موفق شوید، ما بدون هیچ چشم داشتی تجربه خود را در اختیار شما خواهیم گذاشت
گروه تولیدی پژوهشی نیازی







































































































































































































نظرات کاربران
2:27:55 AM